【摘 要】[目的] 聚焦中文医学期刊编辑部工作流程和编辑行为,探讨中文临床研究论文整体质量控制策略。[方法] 结合文献调研、专家访谈、会议讨论等方法,综合评价国内医学期刊发表的临床研究论文质量;从研究者、编辑部、编辑三方面分析其质量影响因素;探讨控制中文医学期刊临床研究论文质量的综合性策略。[结果] 大量单中心、小样本、纯阳性的结果构成中文医学期刊临床研究论文的主体;研究规范性差、方法学缺失、报告质量低等情况普遍存在,导致国内临床研究论文的转化率低。影响我国临床研究质量的研究者层面分级因素有:大量基层医院医师缺乏基本的临床科研思维和研究方法学基础;教学科研型医院的规范化不足;顶级团队的研究缺乏原创性。医学期刊编辑部的构架不适、对临床研究注册和伦理审查要求的忽视、缺乏统一的发表准入条件;医学编辑相关知识储备不足、对国际规范与相关流程不熟等因素,限制了中文临床研究论文整体质量的提升。[结论] 为把好中国临床研究论文质量“出口”关,国内医学期刊编辑部应统一认识:提高临床研究论文发表的“门槛”;身体力行:严格实行临床研究注册制度,复核研究的伦理审查,加强临床研究国际规范、评价工具以及报告清单的认知普及,注明利益冲突以及允许发表阴性结果等。
【关键词】临床研究论文质量;质量控制;医学编辑;出版伦理;临床研究
经过几十年经济高速发展,中国开始拓展国家发展战略,把卫生工作作为重中之重。《健康中国2030规划纲要》的发布,标志着我国卫生与健康改革发展进入新阶段,也对我国临床医学的发展创新提出了新要求。“人口老龄化”使我国疾病负担沉重;“开放二孩政策”带来了新的母婴医学问题……疾病预防治疗效果和卫生经济要兼顾,“中国特色”显著。然而,我国至今仍处于临床医学研究证据的“进口国”地位,大量照搬欧美指南、参考欧美人群数据,缺乏中国人群研究数据仍是一大短板[1]。对此,我国诸多临床医学、流行病学大家多年呼吁要加强临床研究体系建设、生产本土化证据[1]。
作为记载、传播我国医学临床研究科技信息的主要载体,中文医学期刊担负着为各类医疗卫生决策提供证据的重任。近30年来,以临床医学和循证医学专家为主、医学编辑为辅的研究者陆续从论文真实性[2]、研究设计科学性[3,4]、统计学运用正确性[5]、报告质量[6,7]、试验注册[8]及伦理规范[9]等角度,对国内临床研究论文进行抽样调查,结果显示:中文医学期刊发表的临床研究论文质量一直未能获得较高的评价和较广泛的认可。研究者们亦分别从提升临床研究相关人员的理念[10],严格执行研究注册制、过程透明化、报告准确化[11],规范发表伦理[12],提高编辑相关知识认知度[13]以及办刊经验[14]等方面提出控制我国临床研究论文质量的措施。然而,最近的研究结果表明,我国临床医学研究的论文质量[15]以及学术影响力[16]与欧美国家相比总体仍处在一个较低的水平。
本研究旨在对中文临床研究论文的质量进行综合评价;初步分析论文质量的影响因素;聚焦医学期刊编辑部,探讨中国临床研究论文整体质量的控制策略。
1 研究方法
(1)文献综合[17]:从Web of Science、ScienceDirect、PubMed、中国知网、万方数据等数据库查阅、获取文献,对中文临床研究论文质量进行综合评价;从医脉通指南网(http://guide.medlive.cn/)获取近期国内发表的“临床实践指南”,统计其施引文献以评价中文临床研究论文的转化率。(2)专家访谈:结合本课题组2018年9月至2019年5月对国内临床医学、流行病学等领域的专家和医学编辑(共15位)的访谈结果,定性分析中文临床研究论文质量影响因素。(3)小组讨论:聚焦我国医学期刊编辑部,采用会议讨论法制订临床研究论文质量控制措施。
2 中文临床研究论文质量现况与影响因素分析
最新的数据统计:2008—2018年我国临床医学专业发文量为239767篇,占世界份额的8.9%,在世界国家/机构中排名第8;但总被引频次占世界份额的6.06%[18],篇均被引频次却排在第78位[19]。陈汐敏等[16]通过对Essential Science Indicators 数据库的临床研究国际热点论文进行统计,在研究纳入的510篇热点论文中,中国论文仅为6篇,排在第12位(位居第1的美国论文为286篇);且无一进入被引排名的前100位。由此可见:我国临床医学研究论文数量多、质量不高、国际影响力低;临床医学学科发展未能紧跟我国科研产出快速增长的态势。我国今后不仅要重视临床研究发文的数量,更应重视其质量,提高临床科研实力。
2.1 分层级讨论我国临床研究水平的主要影响因素
我国临床研究一直是医学科研创新链中的薄弱环节,整体发展水平远低于欧美国家,且受学科发展的影响较大。截至2018 年11 月底,我国已布局50 所国家级、244所省级临床研究中心,但均处于探索阶段,中心建设水平还有待提高[20],且其学科分布是基于2012年科技部在《关于开展国家临床医学研究中心申报工作通知》中明确指出的重点学科(疾病),如恶性肿瘤、心脑血管病、呼吸系统及代谢系统疾病、慢性肾病等[21]。而非重点学科尤其是辅助学科的临床研究的开展就显得更为滞后。接受本课题组访谈的临床医学专家指出:临床研究的水平直接影响论文质量,而影响临床研究水平的因素应分层级而论。
以麻醉学科为例:我国现有麻醉医师7万余人,麻醉科约1.4万个。其中90%的科室(大量的基层医院)临床研究的障碍在于基本的科研思维和研究方法的缺失,比如科学问题的提出、研究设计方法和统计学的掌握等。余下8%的科室(大型教学研究型医院)主要障碍为研究的标准化不足,比如临床研究注册制度的遵守、伦理学审查、研究质量控制等。最后2%为国内医院排名顶尖的麻醉科,临床研究的最大障碍在于原始创新性不足,缺乏开拓性的选题。以上影响因素均客观存在,因学科发展不同,故层级分布比例有所不同。此外,接受访谈的专家一致认为:国内的临床研究普遍存在方法学不科学、研究实施不严谨、标准有所降低、结论不可信等问题。
2.2 中文临床研究论文普遍存在方法学缺失
前述专家指出我国临床医学研究水平不高,广泛体现于研究者的方法学缺失。毛宗福教授团队[3,22]在2000年前后针对国内临床研究论文在研究设计、统计学应用以及研究实施规范性等方面做了一系列的抽样调查,发现大量的方法学缺陷。陈飞等[4]对《中华眼科杂志》1983—2002 年发表的152篇临床疗效论文进行审读,结果显示我国眼科领域的临床研究论文在随机分组、对照设置、盲法、基线资料、随访、失访、并发症报告及统计分析等方面缺漏较多。吴泰相教授团队[2]报道:1995—2005年发表在中国部分医学期刊上的3137个随机对照试验(Randomized Controlled Trial,RCT)中仅6.7%(103个)为可信;而103个真实的RCT中仅3个能够获得所需信息的80%。本课题组[15]于2017年8月抽样调查了129篇国内临床研究论文方法学论述规范性,结果显示:大部分作者对临床研究方法的基本概念不甚清楚(约45%);样本量确定的随意性(98%)是最突出的问题;逻辑混乱(51%)、应有的基线资料未交待(23%)、对纳入排除概念不清(41%)等问题明显存在。
方法运用正确与否直接关系到研究结果是否有意义、研究结论是否成立。临床研究方法学(Design Measurement Evaluation,DME)最早是20世纪80年代初由欧美引入我国,当时的上海第二医科大学、广东中医药大学和华西医科大学三所大学的流行病学专家是在国内推广DME的先驱。然而推行至今,临床研究基本概念与方法学普及的广度和深度依然不足。
2.3 中文临床研究论文报告质量低、规范性差
国内临床研究论文报告质量(Reporting Quality)低,且在行文思路、结构铺陈、术语规范等方面存在问题。国际上对于临床研究论文报告质量的评估有专门的工具即通用的报告清单[23]。临床研究论文报告欠规范的问题国内外都存在。Hays等[24]调查了2011—2014年间国际五大医学期刊[The New England Journal of Medicine(NEJM)、Annals of Internal Medicine、The Lancet、British Medical Journal(BMJ)、Journal of the American Medical Association(JAMA)]发表的463篇RCT论文摘要,发现CONSORT清单的总体报告率为67%;其中The Lancet最高(78%),NEJM最低(55%)。
尚淑贤等[7]于2017年调查了7 种优秀中文医学期刊(《中华儿科杂志》《中华内科杂志》《中华眼科杂志》《中华医学杂志》《中华外科杂志》《中华妇产科杂志》和《中华皮肤科杂志》)临床研究论文的摘要报告质量,结果显示284篇RCT摘要CONSORT清单总体报告率为46.03%;而条目分项报告率在国内其他研究者的报告中更低[25,26]。温万鑫等[6]对国内采用CONSORT与STRICTA清单评价中医RCT论文(截至2014年8月的数据库中所有文献)的现状与问题进行汇总,得出我国临床研究报告质量呈上升趋势,但评价方法仍需提高与规范。赵宏杰等[9]的调研结果显示:中国影响因子排名前20的医学期刊2016年、2017年发表的RCT论文的研究注册(4.8%)、伦理审查(46.8%)和知情同意(64.1%)的报告率均较低。以上国内调研仅是基于论文的报告情况,对于研究实施的执行效力未作深入调查。
如此现况,不仅暴露了大部分作者对临床研究方法及规范掌握不够,也暴露出国内医学编辑相关知识缺如。根据本课题组前期对国内医学编辑的临床研究方法学及报告规范认知度的抽样调查[13]:近300名被试中仅1.49%熟练掌握相关知识,58.96%表示仅听说过甚至完全没有听过说相关概念;仅4.5%(13名)表示对5 种常见国际医学研究报告规范全部知晓,2.0%(4名)在工作中应用过5 种研究报告规范。由此可见,国内医学期刊编辑的整体专业素养发人深思。尤其值得一提的是:被试中25%的医学编辑不具有医学相关专业背景,深层次揭示了我国医学期刊编辑部构架的弊端。
中文临床研究论文整体质量偏低,上述与编辑部(编辑)相关的因素应引起业界及相关职能部门的重视。
2.4 大量方法学介绍文献未能起到宣教作用
针对临床研究方法学及相关规范的普及状况,本课题组对中国知网、万方数据的临床研究方法学文献进行检索,对357篇检出文献的分析结果显示:自1997年起国内便有研究者开始关注临床研究的规范性问题[27],相继有《中华流行病学杂志》《中国循证心血管医学杂志》《中国实用儿科杂志》《中国循证儿科杂志》《中国循证医学杂志》《协和医学杂志》开设栏目介绍方法学(图1),内容包括:研究设计方案及实施方法宣教、国际报告规范介绍及解读、循证医学系列讲座、偏倚风险评估工具介绍及解读、Meta分析方法等(图2)。这一类文献的时效性和针对性均较强,能够帮助读者构建较为完整的临床研究方法学知识体系,无论是作者还是医学编辑都应系统、反复地学习强化。然而截至2019年8月,除Meta分析讲座文献的平均下载量(5210次)、被引频次(70次)较多之外,其他几项内容的相关文章的平均下载量<200次、被引频次<10次(图2)。
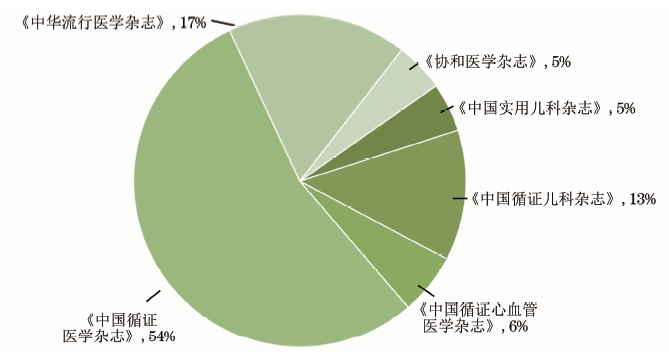
图1 开设临床研究方法学栏目的主要几种医学期刊及刊文数构成比统计(数据统计截至2018年8月1日)
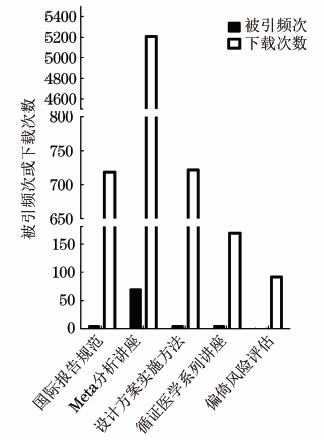
图2 国内临床研究方法学介绍论文平均下载与被引数量统计(数据统计截至2018年8月1日)
以上文献调研数据显示:关注我国临床研究质量及方法学的研究者绝大部分是临床医学、临床流行病学及循证医学专家;编辑的比例极少,可能与其的相关知识储备不足有关。从方法学文献的下载量低可以看出其有效阅读量低,采用期刊论文发表的方式进行方法学宣教的效果不显著;临床研究的基本方法及规范未能普及、未能获得重视。二次研究的方法学在国内却相对受关注,而原始研究的方法学受重视程度严重不足。
2.5 中文临床研究论文转化率极低
临床研究论文被“临床实践指南”及循证医学数据库引用的情况可作为其质量评价的一个重要方面[28]。陈耀龙等[29]报道欧美指南的平均参考文献数量为400篇/部;中国指南的平均参考文献数量为35.6篇/部,其中纳入使用的本土研究论文数量仅为20.9%。本研究从医脉通指南网(http://guide.medlive.cn/)获取由中华医学会、中国抗癌协会、中华中医药学会、中国医药教育协会等及其下设各分会、学组署名公开发表在国内期刊上的100篇新近“临床指南”(数据截止时间:2019年8月1日,其中2018年27篇,2019年73篇),统计其施引的参考文献。结果显示:100篇新近国内“临床指南”平均参考文献数为61.5篇/部;其中,英文文献占80%(49.2篇/部,含中国人群为研究对象的文献数为6.8篇/部);中文文献仅占20%(12.3篇/部)。
转化率低从另一个角度佐证了中文临床研究论文质量不高。中国的临床指南施引文献数量少,并且施引的大部分文献为国外文献。国内期刊发表了大量单中心、小样本、纯阳性结果的临床研究论文,其原始数据的真实性和严谨性均不可考,难以形成推荐意见[30],可供中国指南制定者采纳的本土临床研究证据匮乏。
3 建议
要提升我国临床研究论文的整体质量、令其真正能够有效指导临床、服务“健康中国”,仅从单一的路径切入远远不够;需要多领域、多部门、多人群统一认识、共同协作才能实现。靠期刊论文宣传、有限范围内宣教以及医学界的继续教育尚不能满足中国临床研究规范化的需要。大量标准降低、质量较差的临床研究依然在国内期刊上发表,导致中文临床研究论文质量普遍偏低——这很难将其原因归咎于业界讨论热点中的“评价政策导向”“SCI冲击”等因素上。除了研究者的因素,必然有中文医学期刊自身的原因。
对此,卢嘉锡院士提出的“对科研工作来讲,科技期刊工作即是龙尾,又是龙头”的行动纲领对我国医学期刊编辑具有莫大的警示作用。2008版的《赫尔辛基宣言》增加了第30条:作者、编辑和发行者均对临床研究结果的发表负有伦理责任……不符合该宣言的研究论文不应被接受和发表[31]。国内的医学专家也反复呼吁广大医学编辑要从入口、过程和出口3个环节实时监督临床试验质量[11],为临床试验透明化以及发表伦理作出积极贡献[32]。我们应充分认识医学编辑在控制临床研究质量中的主观能动性,由此本课题组提出以下建议,以期获得国内同行的一致认可和共同践行。
3.1 严格实行临床研究注册制度
临床研究注册是指任何临床试验在开始实施前在公共数据库上公开其所有设计信息,并跟踪已注册试验的结果[32]。国际医学期刊编辑委员会(International Committee of Medical Journal Editors,ICMJE)强制推行从2005年7月1日起其成员期刊只发表在公共机构注册过的临床试验论文,其后临床研究注册制度在国际得到严格执行。2006年4月16日,国内48家(现已增至67家)医药期刊联合发布《成都宣言》:分步实施优先发表、直到只发表具有全球唯一注册号的临床试验报告[33]。然而13年过去了,能够做到的期刊寥寥无几[12]。本课题组呼吁医学编辑重拾《成都宣言》,切实运行中国临床试验注册和发表机制,严把质控第一关。
(1) 注册的目的。①避免研究偏倚;②避免大量简单研究(阳性结果)重复发表;③避免阴性研究结果得不到应有的关注;④比较研究方案与最终试验报告;⑤辨识结果的选择性报告和未公开的修改[34];⑥让公众能够评价研究方案的合法性和普及性[35];⑦履行研究者的伦理责任和义务;⑧保护研究者的知识产权;⑨增加医学研究公信度[36]等。
(2) 哪些临床研究需注册。所有在人体和用取自人体的标本进行的研究均需注册。如:RCT、病例-对照研究、队列研究及非对照研究、预后研究、病因学研究以及各种诊断性(技术、试剂、设备)试验,无论是回顾性还是前瞻性的研究,均需注册并公告[37]。
(3) 临床试验注册3要素。①获得国际唯一注册号;②注册经伦理(审查)委员会批准的原始试验方案及其后续修订;③登记试验结果[38]。
(4) 注册类别与方式。①预注册:指在临床试验实施前进行注册[39]。②后注册:指任何未预注册的已实施或正在实施的临床试验,在发表研究报告以前进行注册[32]。建议编辑部对编辑初审通过的临床研究论文立即展开形式审查,核实该研究预注册情况,尤其是研究设计与注册信息的一致性。此外,通过编辑初审但未经注册的研究论文,虽然中国临床试验注册中心(Chinese Clinical Trial Registry,ChiCTR)推荐由编辑部来负责后注册的流程[32],但因其操作性差未能得以实施。
我们在工作中采取让作者补注册之后再送外审,然而在作者补注册时,ChiCTR却要求RCT试验缴纳3000元费用,回顾性研究在ResMan临床试验公共管理平台(http://www.medresman.org.cn/login.aspx)建立项目并补录数据,造成了作者的财力、人力负担,构成了中文临床研究规范化的阻力。这也说明了对于我国相关部门、领域以及平台的支撑协作亟待进一步增强。
(5) 推荐注册网址。全球已建立了几百个注册库,数量庞大,存在相互不兼容、注册标准不一、无法完成协作等问题。其中美国临床试验注册平台(ClinicalTrials.gov)是全球注册数量最多、区域最广的平台[37],也深受我国研究者青睐。然而为真正实现中国人群临床研究数据的募集和共享,笔者依然推荐中国临床试验注册中心,网址为http://www.chictr.org.cn/index.aspx,希望能借此加快中国临床试验注册中心平台的发展,令其更为完善和高效。
本课题组的小组讨论结果显示,国内临床医师、医学编辑甚至相当比例的医院伦理委员会成员都对临床研究注册与伦理审查的基本流程了解不足。对此,笔者综合了专家访谈及实际论证结果,拟定出临床研究注册流程图(图3),供研究者和编辑借鉴。
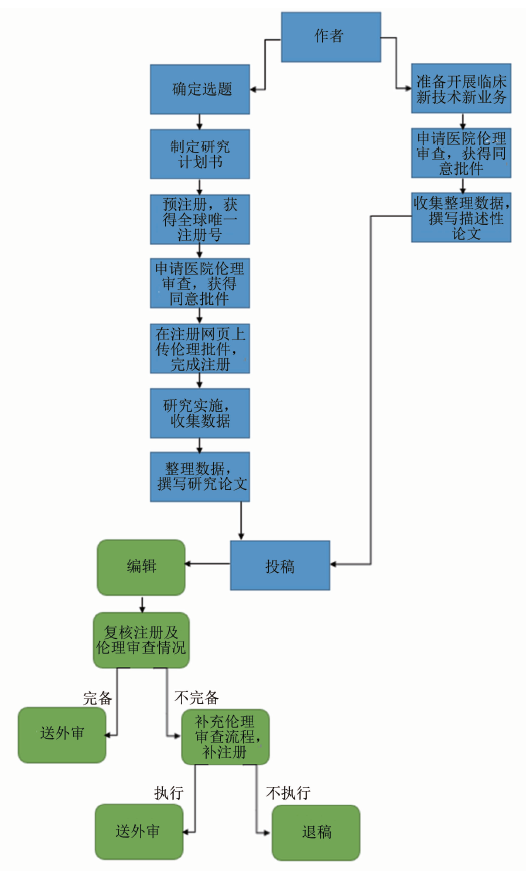
图3 临床研究规范性注册流程图
基于陆军军医大学西南医院伦理委员会审查制度绘制
3.2 严格复核临床研究伦理审查结果
相当一部分国内医学期刊编辑认为伦理审查主要是审查该临床研究是否符合伦理道德、以患者为中心、符合医疗常规、被试者知情同意[40]等问题,由于编辑对伦理审查内容及过程认识不足,最多只是在形式审查时让作者提供“伦理审查批件号”。而设立于各个层级的医院内部的伦理委员会审查的对象是完整的临床研究方案,国内外均推荐采用“SPIRIT 条目清单”梳理计划书[41]。
笔者建议:编辑部应对每一篇临床研究稿件的伦理审查相关手续进行严格复核;一旦出现疑问,让作者同时出具供伦理审查的研究方案。这不失为一种简单有效的判断方法。
3.3 在编辑和作者群中推广临床研究国际规范、评价工具以及报告清单
针对临床研究设计、实施、论文撰写以及质量控制,国际上有各种规范、标准和工具供研究者和医学编辑参考、遵循及使用。如:The Lancet的临床研究分类法则[42]依然可作为研究设计方案及证据质量分级的经典;“SPIRIT2013声明”(2013年,加拿大)[41]可用于指导拟定临床试验计划书;CONSORT(用于RCT,2001年,美国)、STARD(用于诊断试验,2003年,美国)、STROBE(用于观察性研究,2004年,瑞士)等“报告清单”可用于指导计划书和论文的撰写;RoB 2.0、ROBINS-1、QUADAS-2等“偏倚风险评估工具”[43]可用于研究质量控制以及论文偏倚风险的评估。
以上标准和工具是医学编辑必须熟知且经常运用的,其中文译本以及具体解读被广泛刊登在国内医学期刊上,获取方便。此外,临床研究相关概念和设计方案也时常更新,比如近年的“巢式病例-对照研究设计”“真实世界研究”“交互作用研究设计”等,编辑和研究者亦需及时补充相关知识。
3.4 在发表论文中注明利益冲突
临床研究最主要的利益冲突是来自医药企业赞助的研究经费及发表经费;因为这很可能夸大试验组的效果继而误导临床决策[44]。最近有医学编辑部披露出临床论文中因学术竞争冲突导致对诊疗问题的误导[45]。医学编辑应深刻认识临床研究领域的特殊性,临床研究结果直接或间接影响的是广大患者、每个家庭甚至整个社会;报道偏差可能引发各种连锁反应甚至挑起舆情,编辑的公平公正、专业严谨至关重要。应将与临床研究和论文发表相关的诸如企业、审稿人、编辑、期刊经营者、经济利益相关者等[44,45,46,47]存在的、潜在的所有利益冲突事项一同发布。
3.5 阴性结果的发表应引起足够的认识和重视
医学界已经揭示:低质量、简单重复、纯阳性结果的临床研究将导致巨额科研经费与人力的浪费、对研究结果无法全面评价[37];相对于医学研究的实际数据,公开发表的论文可能仅为一小部分;阴性或者非显著性的结果未被报告的概率是未获得阳性结果的两倍。这种发表偏倚将误导临床决策,比如临床医师根据文献而采用了实际上没有临床获益的治疗方法[48]。然而,国内对发表偏倚缺乏重视。笔者建议:编辑及审稿人应重新认识阴性结果的价值,认识到大医学观是阴性结果发表的哲学基础;临床研究注册[36]是阴性结果发表的条件保障。
最后,医学编辑还应有意识地向作者采集并发布卫生经济学数据,以更好地为临床决策提供参考数据。
4 结语
本研究的不足之处在于对于中文临床研究论文的质量评价及影响因素分析大部分是基于文献综合与专家观点,缺乏实证研究数据支撑;且对其影响因素的作用机理未作深入分析。这也是本课题组下一步研究的主要内容。
我国的临床研究及其成果转化具有中国特色,但是降低标准绝不是中国特色。编辑虽微亦要心怀“大医学观”;个刊虽小也要视促进中国临床研究论文质量的整体提升、推动“健康中国”发展进程为己任。对此,本课题组呼吁:每一位医学期刊编辑必须有足够的医学知识储备,熟知临床研究方法,熟悉各种清单、偏倚风险工具、试验注册和伦理审查流程……在审稿、返修的过程中,对国内研究者进行反复教育并矫正其行为,使临床研究的标准和规范在编辑和作者群体能真正普及。只有国内所有医学期刊编辑部联合起来,统一进行规范化要求、严格履行职责、提高临床研究论文发表门槛……才能对提升我国临床研究论文的整体质量起到根本性作用。
参考文献:
[1]魏万林 . 传播临床研究方法提升临床研究质量[J]. 中国循证心血管医学杂志, 2017,9(1):1.
[2]Wu T X, Li Y P, Bian Z X ,et al. Randomized trials published in some Chinese journals:How many are randomized?[J]. Trials, 2009,10:46.
[3]毛宗福, 丁元林 . 临床诊断试验论著质量分析[J]. 中华医院管理杂志, 1998,14(2):105-106.
[4]陈飞, 曾艳彩, 魏厚仁 . 从循证医学角度分析中华眼科杂志已发表临床疗效研究论文的质量[J]. 中华眼科杂志, 2004,40(9):609-613.
[5]毛宗福, 陈冬峨, 叶金华 , 等. 医学论著中统计学应用缺陷与课程教改研究[J]. 西北医学教育, 2000,8(1):35-37.
[6]温万鑫, 卢静敏, 陆丽明 , 等. 国内应用CONSORT及STRICTA评价RCT的现状分析[J]. 中医杂志, 2015,56(18):1559-1563.
[7]尚淑贤, 颜艳, 吴晓初 . 中文临床医学期刊随机对照临床试验摘要报告质量评估[J]. 中国科技期刊研究, 2017,28(12):1121-1127.
[8]吴泰相 , 米娜瓦尔•阿不都,卞兆祥,等. 基于临床试验注册信息调查影响我国临床试验质量的因素[J]. 中国循证医学杂志, 2018,18(6):526-531.
[9]赵宏杰, 张俊华, 郭利平 , 等. 我国高影响因子中文医学期刊发表随机对照试验注册、伦理、知情同意报告现状及质量评价分析[J]. 中国循证医学杂志, 2018,18(7):735-739.
[10]李幼平, 李静, 刘雪梅 . 建立CONSORT声明中国传播协作网提高中国临床试验报告质量[J]. 中国循证医学杂志, 2005,5(8):591-592.
[11]杜亮, 李幼平, 张永刚 . 强化两端, 健全高质量证据生产的全程质控[J]. 中国循证医学杂志, 2017,17(11):1241-1244.
[12]吴泰相, 李幼平, 郑尚维 , 等. 推动我国医学期刊发表伦理发展的联合声明[J]. 中国循证医学杂志, 2011,11(12):1351-1353.
[13]李娜, 李洁, 孙菲 , 等. 我国医学期刊编辑对医学研究报告规范的认知度[J]. 中国科技期刊研究, 2019,30(4):358-363.
[14]中国科学技术协会. 中国科技期刊发展蓝皮书(2019):世界一流科技期刊发展路径专题[M]. 北京: 科学出版社, 2019: 241.
[15]栾嘉, 徐迪雄, 李高明 . 国内医学临床研究论文方法学论述问题分析及规范化建议[J]. 中国科技期刊研究, 2018,29(1):32-36.
[16]陈汐敏, 丁贵鹏, 接雅俐 , 等. 国际临床医学研究领域热点论文产出状况分析及对我国医学期刊的启示[J]. 中国科技期刊研究, 2013,24(6):1079-1084.
[17]蔡羽嘉, 陈耀龙, 王梦书 , 等. 循证医学术语介绍(VI)[J]. 中国循证医学杂志, 2009,9(9):942-945.
[18]中国科学技术信息研究所. 2018中国国际科技论文产出状况[R]. 北京: 科学技术文献出版社, 2018.
[19]中国科学技术信息研究所. 2017中国国际科技论文产出状况[R]. 北京: 科学技术文献出版社, 2017.
[20]辛红霞, 邵倩倩, 何慧娟 , 等. 我国临床医学研究中心现状分析[J]. 中国医院管理, 2019,39(8):32-35.
[21]科技部. 科技部关于开展国家临床医学研究中心申报工作的通知[EB/OL]. [ 2019- 11- 01]. .
[22]毛宗福, 丁元林, 陈东峨 , 等. 临床论著中统计推断应用缺陷特征及对策[J]. 中国卫生统计, 1998,15(3):56-57.
[23]李幼平, 杜亮, 刘雪梅 . 推进临床试验注册和规范化报告,从入口到出口把关临床试验质量[J]. 中国循证医学杂志, 2010,10(1):1-2.
[24]Hays M, Andrews M, Wilson R ,et al. Reporting quality ofrandomised controlled trial abstracts among high-impact general medical journals:A review and analysis[J]. BMJ Open, 2016,6(7):e011082.
[25]Chen Y L, Li J, Ai C L ,et al. Assessment of the quality of reporting in abstracts of randomized controlled trials published in five leading Chinese medical journals[J]. PLoS ONE, 2010,5(8):e11926.
[26]田金徽, 黄紫涵, 葛龙 , 等. 中文发表的乳腺癌随机对照试验摘要报告质量调查[J]. 中华全科医学, 2016,14(7):1182-1185.
[27]洪明晃, 方积乾 . 无复发生存率和无转移生存率在肿瘤研究中的作用[J]. 中华肿瘤杂志, 1997,19(3):239.
[28]张燕舞, 唐小利, 杜建 . 循证医学视角下临床研究文献影响力评价[J]. 中华医学图书情报杂志, 2016,25(2):10-13.
[29]陈耀龙, 元博, 孙丽娜 , 等. 中国大陆临床实践指南引文分析[J]. 中国循证儿科杂志, 2013,8(6):467-470.
[30]王云云, 靳英辉, 陈耀龙 , 等. 循证临床实践指南推荐意见形成的方法分析[J]. 中国循证医学杂志, 2017,17(9):1085-1092.
[31]李幼平, 吴泰相, 商洪才 , 等. 推动我国循证医学发展的策略和措施:循证医学教育部网上合作研究中心/中国循证医学中心2008年度工作会议纪要[J]. 中国循证医学杂志, 2009,9(2):138-142.
[32]吴泰相, 李幼平, 李静 , 等. 中国临床试验注册和发表机制及实施说明[J]. 中国循证医学杂志, 2006,6(6):395-396.
[33]李幼平, 吴泰相, 李静 , 等. 创建中国临床试验注册和发表机制的联合宣言[J]. 第三军医大学学报, 2006(15):1639-1640.
[34]Dwan K, Altman D G, Cresswell L , et al. Comparison of protocols. Comparison of protocols and registry entries to published reports for randomised controlled trials[J/OL]. Cochrane Database of Systematic Reviews, 2011 (1). .
[35]Chan A . Out of sight but not out of mind:How to search for unpublished clinical trial evidence[J]. British Medical Journal, 2012,344:d8013.
[36]吴泰相, 李幼平, 刘关键 , 等. 中国临床试验注册中心及中国循证医学中心提高我国临床试验质量的策略和措施[J]. 中国循证医学杂志, 2010(11):1243-1248.
[37]邬兰, 田国祥, 王行环 , 等. 临床试验的注册及注册平台比较分析[J]. 中国循证心血管医学杂志, 2017,9(2):129-134.
[38]Askie L . Trial registration records,updates,and protocols[J]. The Lancet, 2016,388(10042):341-342.
[39]吴泰相, 李幼平, 姚巡 , 等. 实行临床试验注册制度,提高我国临床研究质量[J]. 中国循证医学杂志, 2006,6(3):153-156.
[40]张新庆, 李传俊, 蔡笃坚 . 30年来我国临床伦理研究主题之特点与反思——基于《中国医学伦理学》刊登论文的分析[J]. 中国医学伦理学, 2018,31(4):461-466.
[41]Chan A W, Tetzlaff J M, Altman D G, et al. SPIRIT 2013声明:定义临床研究方案的标准条目[J]. 中国循证医学杂志, 2013,13(12):1501-1507.
[42]Schulz K F, Grimes D A. The Lancet handbook of essential concepts in clinical research[M]. 北京: 人民卫生出版社, 2010.
[43]杨智荣, 孙凤, 詹思延 . 偏倚风险评估系列:(一)概述[J]. 中华流行病学杂志, 2017,38(7):983-987.
[44]潘伟, 游苏宁 . 5种医学期刊中经济利益冲突问题的调查及分析[J]. 编辑学报, 2002,14(3):195-197.
[45]栾嘉, 邓强庭, 黄超 , 等. 科技期刊论文学术观点冲突的应对及案例分析[J]. 中国科技期刊研究, 2019,30(9):1003-1006.
[46]陈立敏, 钱寿初 . 国内生物医学期刊应公开稿件中的利益冲突[J]. 中国科技期刊研究, 2011,22(4):617-619.
[47]杨颖, 游苏宁 . 与医学期刊相关的利益冲突及其对策[J]. 中国科技期刊研究, 2008,19(1):129-132.
[48]Proehl J A, Alexander S, Manton A . Integrity and transparency in reporting clinical trials[J]. Journal of Emergency Nursing, 2017,43(2):96-97.


